A 3D bionyomtatás egy additív gyártási folyamat , amelyben szerves és biológiai anyagokat, például élő sejteket és tápanyagokat kombinálnak, hogy olyan mesterséges struktúrákat hozzanak létre, amelyek hasonlóak, mint a természetes emberi szövetek.
Más szavakkal, a bionyomtatás a 3D nyomtatás egy olyan típusa , amely potenciálisan képes bármilyen dolgot előállítani a csontszövetektől a vérerekig vagy akár egészen az élő szövetekig a különböző orvosi alkalmazásokhoz, beleértve a szövetmérnöki és a gyógyszeres tesztelés és fejlesztés területeit is.
A 3D bionyomtatás talán legjelentősebb mozgatórugója a regeneratív gyógyászat. Chris Mason és Peter Dunnill szerint ez magában foglalja az emberi sejtek, szövetek vagy szervek helyettesítését vagy regenerálását a normális funkció helyreállítása vagy kialakítása érdekében. Itt a bioprintingnak központi szerepe lehet, különösen tekintettel a világszerte magas szerv- és szövetátültetési igényre.
Ebben a cikkben a 3D bionyomtatás néven ismert lenyűgöző és futurisztikus technológiát fogjuk együtt felfedezni. Kitérünk a legfontosabb szempontokra, beleértve a fő alkalmazásokat, azok működését és, hogy ezek hogyan befolyásolhatják a tudomány előrehaladását a jövőben.
Fő alkalmazások
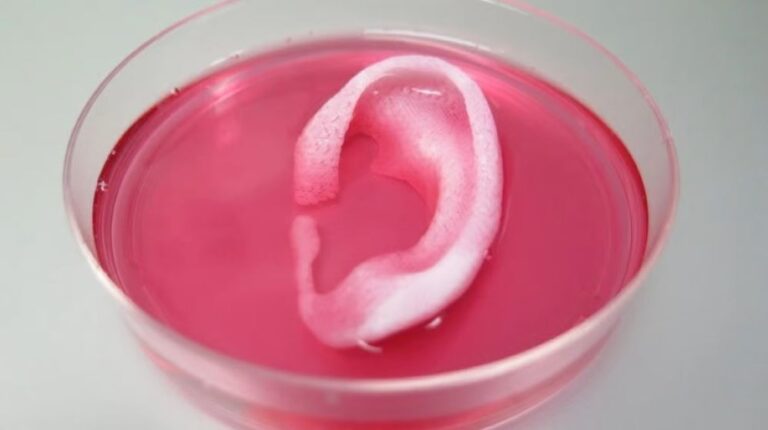
A bionyomtatási technológiával előállított termékek testünk természetes struktúráinak és szöveteinek biológiai és funkcionális tulajdonságait egyaránt képesek utánozni. Ez potenciálisan különféle alkalmazásokhoz vezethet, de ma a bionyomtatásnak csak egy lehetséges felhasználási területe van, ami a gyógyszerészeti gyógyszertesztelés és kutatás.
Míg a 3D bionyomtatás végső célja mesterséges szervek előállítása transzplantáció céljából (amint azt a következőkben látni fogjuk), a valódi szervként működő szervek létrehozása, viszont bonyolultsága miatt, jelenleg még ilyen szervek létrehozására nem vagyunk képesek, azonban a tudósok ma már sikeresen létrehozhatnak olyan biológiai struktúrákat és szöveteket, amelyek utánozzák a természetes sejteket és szöveteket.
Tehát jelenleg teljesen működő vese bionyomtatása nem lehetséges, helyette a kutatók már létrehozhatnak olyan struktúrákat, amelyek kémiailag úgy viselkednek, mint a veseszövetek. Bár távol állnak az eredeti céltól, ezek a struktúrák új gyógyszerek tesztelésére használhatók anélkül, hogy valós betegekre kellene hagyatkozniuk, akik váratlan mellékhatásoktól szenvedhetnek.
Az etikai részen túl a bionyomtatott anyagokkal történő gyógyszerfejlesztés sokkal költséghatékonyabbá teheti az új gyógyszerek preklinikai kipróbálását, elősegítve azok validálását és gyorsabb piacra jutását, ugyanakkor potenciálisan csökkenti az állatkísérletek szükségességét is, ami már önmagában egy jelentős lépés.
Jövőbeli alkalmazások
A 3D bionyomtatás alapvetően regeneratív gyógyászati eszközként indult. Az átültetés céljára szolgáló mesterséges szervek előállítása megoldaná a nagy kereslet és az alacsony rendelkezésre állás problémáit, valamint a szervkilökődéssel járó műtétek utáni szövődményeket, hiszen az előállított szerveket a páciens saját szerves anyagából fejlesztenék ki, így a kilökődés esélye jelentős mértékben csökkenhet.
Míg a szervcsere a végső cél, addig a szövetek helyreállítása is nagyon ígéretes eredményeket mutat. A teljes funkcionális szervek létrehozása helyett a kis szövetfoltok potenciálisan felhasználhatók olyan szervek regenerálására és kezelésére, mint a máj és a szív . A csont- és bőrátültetés is profitálhat a technológiából, beleértve a rekonstrukciós és esztétikai célú műtéteket is.
Mindkét, a regeneratív gyógyászathoz kapcsolódó alkalmazás még fejlesztés alatt áll, és csak néhány sikeres eset van kutatólaboratóriumokban, mint például a Torontói Egyetem projektje, amely az égési sérülésekre bőrt nyomtat.
Hogyan működik?

Lényegében a 3D bionyomtatás a hagyományos 3D nyomtatáshoz hasonlóan működik : a digitális modelleket rétegről rétegre történő gyártási technikák segítségével fizikai háromdimenziós objektummá alakítják.
Számos bionyomtatási módszer áll rendelkezésre, beleértve az extrudáláson alapulókat , ahol az anyagokat egy tűről ürítik ki rétegek létrehozásához, és a lézerrel támogatott technológiákat, ahol a lézer hőforrásként segíti az anyagok lerakódását a hordozóra, hasonló folyamatban, mint a szelektív lézeres olvasztás (SLM) .
A bionyomtatási módszertől függetlenül a szervetlen nyersanyagok, például filamentum, gyanta és fém helyett itt biológiai anyagokból és élő sejtekből áll az alapanyag.
Ezeket az anyagokat biotintáknak nevezik , amelyek főként élő anyagokból állnak, például sejtekből egy megfelelő hordozóanyagban – például kollagénben, zselatinban, hialuronban, selyemben, alginátban vagy nanocellulózban –, amelyek molekuláris vázként működnek a szerkezet növekedéséhez és a tápanyagok biztosításához, támogatásához.
Általánosságban elmondható, hogy a bionyomtatási folyamat egésze több lépésből áll, amelyek három fő szakaszban foglalhatók össze: az előkészítés, amely a digitális modell létrehozásából áll (a hagyományos 3D nyomtatás 3D modellezési szakaszaihoz hasonlóan); maga a rétegenkénti építési folyamat; és a bionyomtatás utáni szakaszok, amelyek mechanikai és kémiai stimulációt foglalnak magukban a struktúrák és az érett biológiai anyagok stabilizálása érdekében.
A következő részben egy általános 3D bionyomtatási munkafolyamat egyes lépéseit részletezzük.
A bionyomtatás legfontosabb lépései
A különféle 3D bionyomtatási típusok és módszerek ellenére egy tipikus folyamat nagyjából ugyanazt a szabványos lépéssorozatot követi.
Készítmény
- 3D képalkotás: A 3D szkennelés a hagyományos 3D nyomtatáshoz hasonlóan a normál számítógépes tomográfiát (CT) és a mágneses rezonancia képalkotást (MRI) is felhasználják, hogy a lehető legtöbb információt szerezzék meg a biológiai struktúrákról és környezetükről.
- 3D modellezés: A szerkezet vagy szövet tényleges háromdimenziós modelljét speciális szoftver állítja elő. A modellt mikroléptékben fejlesztik, már figyelembe véve a rétegenkénti gyártási módot és a hordozóanyagokat.
- Biotinta előkészítése: A biotinta típusa és előkészítése az adott bionyomtató nyomtatási módszerétől függ. Például az extrudáláson alapuló bionyomtatási eljárásokban a biotintának egy nagyon viszkózus folyadéknak kell lennie, hogy az extrudálás után megőrizze a relatív szerkezetét, míg más módszereknél, mint például a tintasugaras vagy a mikrofluiditást igénylő eljárásoknál a nyersanyagnak folyékonyabb állapotban kell lennie, hogy megfelelően folyjon.
Építés (vagy 3D nyomtatás)
- Nyomtatás: A módszertől függetlenül a 3D bionyomtatási folyamat magában foglalja az anyag rétegről rétegre történő lerakását. A nyomtatási felbontás hihetetlen egysejtű lerakódást érhet el egyes bionyomtatási eljárásokban, mint például a Fluicell mikrofluidikus áramlási nyomtatása .
Bionyomtatás utáni
- Térhálósítás: Nyomtatás után az anyagok még viszonylag lomha állapotban vannak, ezért további lépésre van szükség a megfelelő megszilárduláshoz és összekeveréshez. Ezt keresztkötésnek nevezik, ami egy elengedhetetlen lépés a nyomtatott szerkezet mechanikai és kémiai tulajdonságainak biztosításához. A térhálósítás különféle környezeti szabályozásokat, például UV-fényt, hőmérsékletet és vegyszereket használhat.
- Érés: Végül a bionyomtatott és térhálósított struktúráknak növekedniük kell – biológiailag. Ez azt jelenti, hogy a nyomtatott élő sejtek szaporodnak, és a szövetek a mögöttes nyomtatott struktúrákat követve növekednek. Ezt a lépést inkubációnak is nevezik, és bioreaktorokban történik, amelyek kedvező környezetet teremtenek a szaporodáshoz és a szövetek növekedéséhez.
3D bionyomtatók
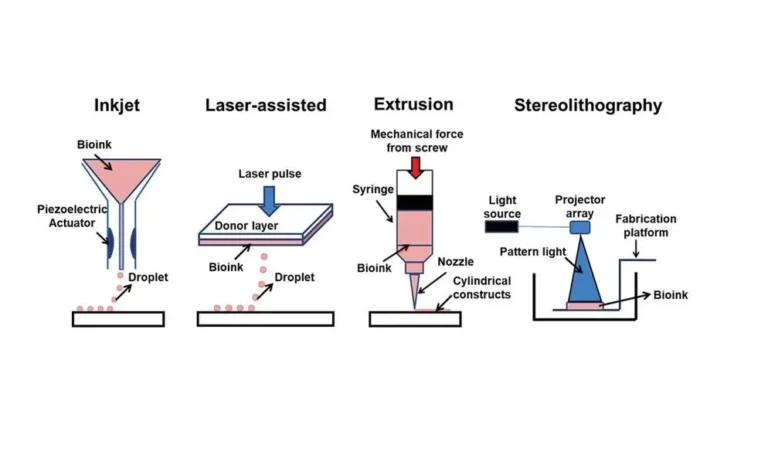
Sokak számára meglepő lehet, hogy a 3D bionyomtatók piaca nem kicsi. Kezdetben különböző bionyomtatási módszerek álltak rendelkezésre, amelyek négy fő kategóriába sorolhatók: extrudálás alapú , tintasugaras alapú , lézerrel segített és sztereolitográfiás .
Mindegyik módszer különböző előnyöket és hátrányokat kínál, és mindegyik különöböző módon felel meg bizonyos bionyomtatási célokra. A szerény asztali gépektől a hatalmas bionyomtató állomásokig a berendezések méretét, funkcionalitását és rendeltetését tekintve nagy a változatosság. Nézzünk meg néhány bionyomtatót, hogy jobban illusztráljuk az eseteket.

Vegyük például az Allevi bionyomtató sorozatot, amelyet az azonos nevű amerikai cég fejlesztett ki. Ezek kisméretű, extrudáláson alapuló asztali nyomtatók, amelyek kis fecskendőket használnak a biotinták és hidrogélek hihetetlen pontosságára (akár 1 μm-ig).
A bonyolultság szempontjából a ranglétrán feljebb haladva a francia Poietis cég NGB-R bionyomtatója egyetlen technológiában egyesíti a különböző bionyomtatási leválasztási módszereket, amely magában foglalja a lézerrel segített és az extrudáláson alapuló technikákat. Ez a bionyomtató elsősorban mesterséges emberi szövetek előállítására összpontosít kutatási és fejlesztési célokra.
Végül, de határozottan nem utolsósorban, a koreai székhelyű Rokit nagyméretű Dr. Invivo 4D6 egy teljes körű biogyártási állomás, amely UV-kamrás sterilizálást, optikai mikroszkópot, beépített sejtinkubátort és opcionális fagyasztott építőlemezt tartalmaz, amellyel elérhető a -30 C° hőmérséklet is. És igen, extrudáláson alapuló 3D bionyomtatásra is képes.
Mint látható, a bionyomtatók piaca nagyon változatos.
Legutóbbi fejlemények

Bár még mindig nagyon messze vagyunk a mesterséges szervek és emberi szövetek tömeggyártásától, nem szokatlan az új, izgalmas fejleményekről hallani a biogyártás területén az elmúlt években.
2019 áprilisában a sajtó világszerte beszámolt az első vaszkularizált 3D nyomtatott miniatűr szívről, amelyet a Tel Aviv Egyetem Molekuláris Sejtbiológiai és Biotechnológiai részlege fejlesztett ki . A mini-szervet páciensspecifikus anyagok felhasználásával hozták létre, de semmilyen funkcionalitást nem mutatott.
Azonban alig néhány hónappal az izraeli kutatók áttörése után az amerikai BioLife4D biotechnológiai vállalat bejelentette, hogy készítettek egy saját bionyomtatott szívet , amely nagyobb, és megismételte az emberi szívekben található funkciókat.
Újabb hatalmas fejlesztést értek el a szervek bionyomtatásában a New York-i Rensselaer Polytechnic Institute kutatói. 2019-ben sikerült teljesen vaszkularizált bőrfoltokat létrehozniuk . A bőr az emberi test legnagyobb szerve, a páciens saját sejtjeiből készült mesterséges tapaszok pedig lehetővé tennék a súlyos égési sérülések gyors kezelését. A csapat most a transzplantáció fejlesztésére és a tapaszok érrendszerének közvetlenül a páciens testébe történő integrálására összpontosít.
Mit hoz a jövő?
A bionyomtatók növekvő piaca, valamint a szövetfejlesztés és a regeneratív gyógyászat iránti fokozott érdeklődés miatt egyértelmű, hogy a bionyomtatási technológiák sokkal inkább gyorsabb fejlődésnek indulnak.
Valóban igazolni fogja értékét erkölcsi és etikai szempontból is, ami mindig jelentős kihívást jelent az orvostudománynál és a természethez kapcsolódó technológiákban. Kíváncsian várjuk, hogy hova fejlődik a technológia néhány évtized múlva, de addig is feltétlenül olvassa el a 3D-nyomtatásról és az egészségügyről szóló egyéb cikkeket is , beleértve a protézisek gyártását és az orvosi eszközöket.
Eredeti forrás: All3dp.com








